Sativex: Zulassungsantrag für die USA bei der FDA gestellt
Ein Vierteljahrhundert nachdem die Nahrungs- und Arzneimittelbehörde der USA, die FDA, die erste verschreibungsfähige Arznei basierend auf dem Hauptwirkstoff der Cannabispflanze, dem THC, zugelassen hat, machen sich andere Medikamente, die auf den Cannabiswirkstoffen oder ihrem wirksamen Prinzip beruhen, auf den Weg in die Apotheken.
Die britische Firma GW Pharmaceuticals ist in den fortgeschrittenen klinischen Studien für das erste pharmazeutische, aus rohem Marihuana anstelle von synthetischen Äquivalenten hergestellte, Produkt – einem Mundspray, von dem sie hoffen den Markt in den USA bei der Behandlung von Krebsschmerzen zu erreichen. GW geht von einer Marktzulassung zum Ende 2013 aus.
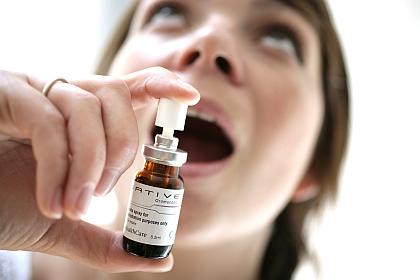
Sativex enthält die zwei gut bekannten Komponenten aus den Cannabisblüten: delta9-THC und Cannabidiol. Es wurde schon in Kanada, Neuseeland und acht europäischen Ländern, darunter Deutschland, bei verschiedenen Krankheitsbildern zugelassen, zum Beispiel zur Entspannung der Spastiken bei Multipler Sklerose.
Die Zulassung durch die FDA würde einen wichtigen Meilenstein der oft unklaren Beziehung zwischen der USA und Marihuana setzen. In 16 Bundesländern sowie dem Gebiet Columbia ist es den Einwohnern schon möglich, auf Empfehlung eines Arztes, medizinisches Marihuana zu erhalten. Die US-Drogenverfolgungsbehörde DEA sieht Gras noch immer als gefährliche Droge ohne medizinischen Wert an, aber die Verfügbarkeit von chemisch ähnlichen, verschreibungsfähigen Medikamenten erhöht den Druck auf die Föderalregierung, ihre Position zu überdenken und anderen Pharmafirmen die Möglichkeit geben, GW Pharmas Fußstapfen zu folgen.
Weiteres auch beim Selbsthilfenetzwerk Cannabis als Medizin: „SATIVEX“ – schillernde Seifenblase mit „PLOP-Faktor“ und Erste Erfahrungen mit Sativex.

















Die reden sich dann eh nur wieder raus vonwegen „isolierte Wirkstoffe“ und so.
P.S.: Die Antwort von der Dyckamnns auf deine letzte Frage bei abgeordnetenwatch.de war ja wohl n Witz bzw. ein Zeichen geistiger Umnachtung. Die hat die Frage ja überhauptnicht verstanden!